Andi Cahyadi, Ferry Efendi, Faisal Hudayana
Fakultas Kedoteran Universitas Airlangga 2005
Perjalanan infeksi Human Immunodeficiency Virus (HIV) sangat bervariasi antara orang yang satu dengan yang lainnya dan belum sepenuhnya dimengerti. Faktor imunologis dan virologis telah diketahui berhubungan dengan progresifitas HIV tetapi survival penderita untuk jangka panjang masih sulit dipertahankan. GB Virus C (GBV-C) dan Virus Hepatitis G adalah virus yang sama dari isolat yang berbeda, bereplikasi di limfosit, serta berhubungan dengan penurunan resiko kematian pada penderita HIV positif. Penelitian sebelumnya menyatakan bahwa penderita dengan HIV yang koinfeksi dengan GBV-C menunjukkan perlambatan progresifitas HIV/AIDS.
Mekanisme perlindungan dari efek yang ada dapat diidentifikasi dari sejumlah kemungkinan. GBV-C diduga sangat bermanfaat pada infeksi HIV dengan mekanisme yang terkait normalisasi waktu paruh (half life) sel T CD4+ serta penurunan kadar virus (viral load) HIV dengan cara menghambat replikasi virus tanpa menyebabkan kerusakan sel. GBV-C berkorelasi positif terhadap peningkatan jumlah sel T CD4+. Hal yang menarik adalah kadar GBV-C darah justru meningkat pada penderita HIV yang mendapat pengobatan antiretrovirus.
Gambar 1. Struktur HIV (Tillman, 2001)
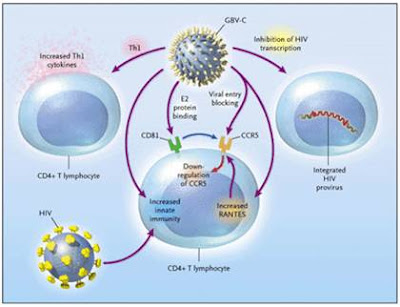
Perubahan pada profil sitokin penderita yang terinfeksi ganda GBV-C dan HIV ditunjukkan dengan peningkatan kadar sitokin Th1 (T helper 1) salah satunya adalah interleukin 2 (IL-2). Penderita HIV akan mengalami beberapa fase diantaranya fase akut, asimptom dan fase krisis atau AIDS. Pada saat penderita HIV memasuki fase AIDS dan hanya terinfeksi HIV, terjadi peningkatan kadar sitokin Th2 (T helper 2) yaitu IL-4 dan IL-10 dan terjadi penurunan kadar sitokin Th1. Perubahan respon sel T helper menjadi kunci pada perjalanan AIDS pada penderita yang terinfeksi HIV. Peningkatan sitokin Th2 secara gradual dibandingkan dengan sitokin Th1 pada penderita HIV diasosiasikan dengan terjadinya AIDS. Ketahanan sitokin T helper pada penderita yang terinfeksi HIV dan GBV-C bertanggungjawab pada mekanisme respon imun protektif pada koinfeksi ini.
Replikasi HIV dihambat secara langsung dan tidak langsung oleh GBV-C yang didukung fakta HIV dan GBV-C dapat menginfeksi dan bereplikasi dalam sel tropism (sel sasaran utama) yang sama, sehingga terjadi interaksi dalam siklus hidupnya. Berbagai tahap siklus hidup HIV dipengaruhi GBV-C mulai tahap pengikatan HIV ke sel target melalui reseptor CD4+ dan koreseptor (chemokine), internalisasi, reverse transcription dan integrasi ke dalam genom sel untuk membentuk provirus HIV, transkripsi dan translasi virus serta pembelahan dan pembentukan (morphogenesis) HIV.
GBV-C dapat memblok masuknya HIV ke dalam target seluler yang penting, misalnya limfosit T CD4+ dan makrofag. Di dalam kultur sel, protein envelope E2 GBV-C menurunkan masuknya HIV melalui penurunan regulasi koreseptor kemokin 5 (downregulation chemokin coreceptor 5/ CCR5) HIV. Downregulation ini tampak dengan hasil dari ikatan langsung E2 GBV-C dalam CD81 pada CCR5, peningkatan betachemokin terutama RANTES (regulated upon activation normal T-cell expressed and secreted) pada penderita dengan infeksi ganda. RANTES mengikat CCR5 dan kemudian dapat memblok masuknya virus secara langsung atau dapat bekerja walaupun sudah terjadi downregulation dari CCR5.
Perjalanan klinis infeksi GBV-C ini sangat unik. Dengan mekanisme yang belum seluruhnya diketahui, GBV-C mampu terbebas dari respon imun di dalam tubuh manusia. Beberapa bukti yang mendukung pernyataan tersebut adalah pertama, GBV-C mampu bertahan lama dalam tubuh manusia sampai lebih dari 15 tahun. Kedua, selama RNA GBV-C positif, dalam darah manusia tidak ditemukan adanya antibodi terhadap GBV-C. Begitu juga sebaliknya setelah seseorang bebas dari infeksi GBV-C (tidak dijumpai RNA GBV-C dalam darah) barulah muncul antibodi terhadap protein E2 GBV-C. Ketiga, GBV-C merupkan low density particle sehingga mempunyai daya immunogenitas yang rendah.
Beberapa alternatif penggunaan GBV-C sebagai terapi biologis adalah GBV-C diberikan dalam bentuk vaksin, baik sebagai vaksin hidup, dilemahkan, mati maupun fraksi komponen protein. Tetapi mengingat mekanisme kerja GBV-C dalam menghambat progresifitas HIV, vaksin yang berasal dari GBV-C hidup yang tidak dilemahkan nampaknya lebih cocok karena dapat menghambat progresiftas HIV dengan berbagai cara sesuai dengan yang diterangkan di atas. Pemberian virus ini diharapkan tidak berbahaya, karena sampai saat ini tidak ada bukti yang menunjukkan virus ini menyebabkan penyakit serius pada manusia, kecuali bila bersama infeksi hepatitis B. GBV-C masih belum direkomendasikan WHO sebagai pilar terapi HIV, namun mengingat akan manfaat dari GBV-C dalam menghambat progresifitas HIV, maka perlu dipertimbangkan pemanfaatan GBV-C sebagai terapi adjuvan terhadap terapi antiretrovirus.
Untuk menjamin kontinuitas terapi biologis GBV-C dalam menghambat progresifitas HIV/AIDS maka diperlukan media budidaya GBV-C yang tepat. Sampai saat ini belum banyak media budidaya untuk GBV-C, namun telah diketahui bahwa GBV-C dapat diinokulasikan pada beberapa primata, yaitu simpanse, tamarin dan macaca. Keuntungan cara ini adalah hewan primata merupakan hewan yang secara anatomi fisiologi cukup dekat dengan manusia sehingga GBV-C dapat hidup seperti layaknya dalam tubuh manusia. Keuntungan yang dapat diharapkan pada pengembangbiakkan GBV-C di dalam tubuh hewan primata adalah biaya yang diperlukan relatif murah.
Pengembangbiakkan GBV-C dalam skala industri dapat dilakukan pada sel ginjal kera atau vero cells. Sel ginjal kera yang komersial digunakan untuk kultur virus dalam jumlah besar. Sel ginjal kera tersebut merupakan sel immortal dan virus dapat cepat berkembangbiak. Sehingga diharapkan dengan cara ini, kebutuhan akan GBV-C dalam jumlah banyak akan dapat terpenuhi dan tidak ditemui kesulitan-kesulitan seperti pada pengembangbiakkan GBV-C pada primata.

Tidak ada komentar:
Posting Komentar